PNAS:饶子和、贡红日与王权团队共同揭示了带有膜包被Rieske FeS簇的分枝杆菌琥珀酸脱氢酶的结构
2021年4月,上海科技大学、南开大学、中国科学院生物化学与细胞生物学研究所等单位的相关研究人员在《PNAS》(IF: 9.58)上发表了题为“Architecture of the mycobacterial succinate dehydrogenase with a membrane-embedded Rieske FeS cluster”的研究论文,测定了存在和不存在底物辅酶Q1的耻垢分枝杆菌Sdh1的低温电子显微镜(cryo-EM)结构,揭示了Sdh1新颖的电子转移途径和独特的底物结合位点。

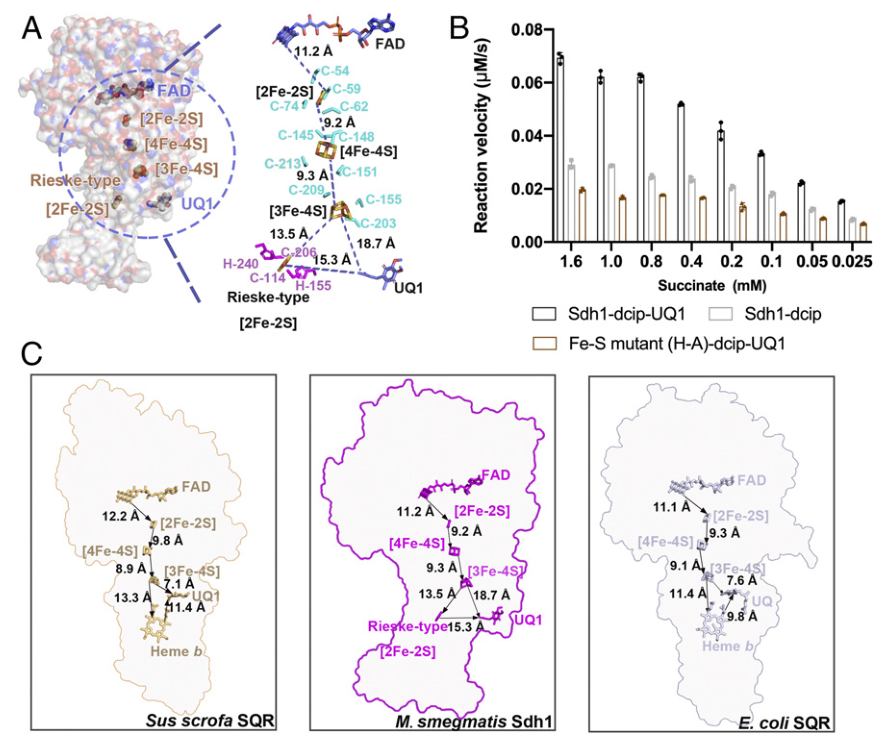
解析了耻垢分枝杆菌Sdh1在天然状态及与底物结合状态的两种高分辨率结构。 Sdh1与其他类型的复合物IIs相比具有不同的醌结合位点。 在Sdh1跨膜结构域中发现了一个Rieske型[2Fe-2S]簇,是醌还原所必需的。 与哺乳动物相比,结核分枝杆菌Sdh1的醌结合位点存在显著差异
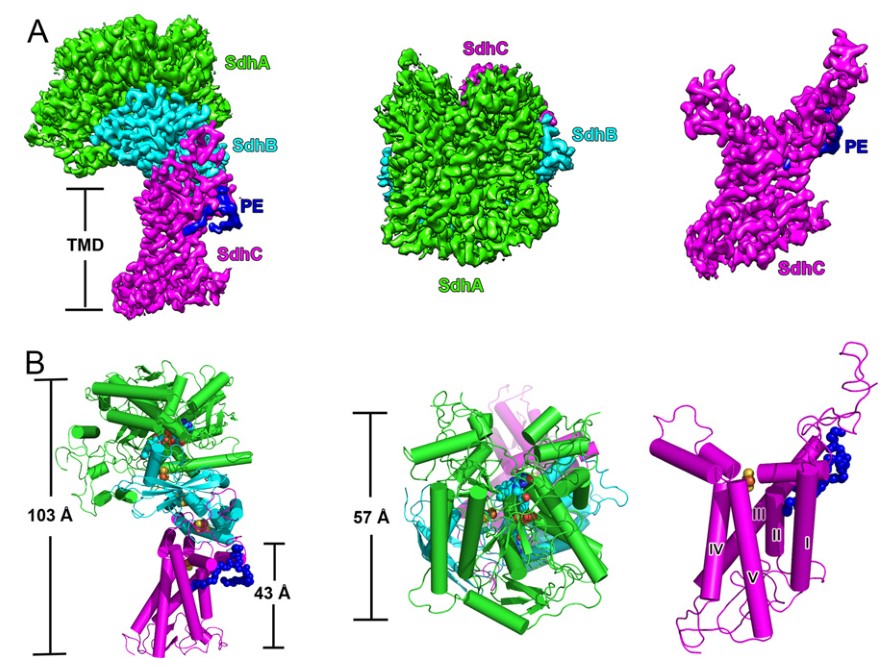
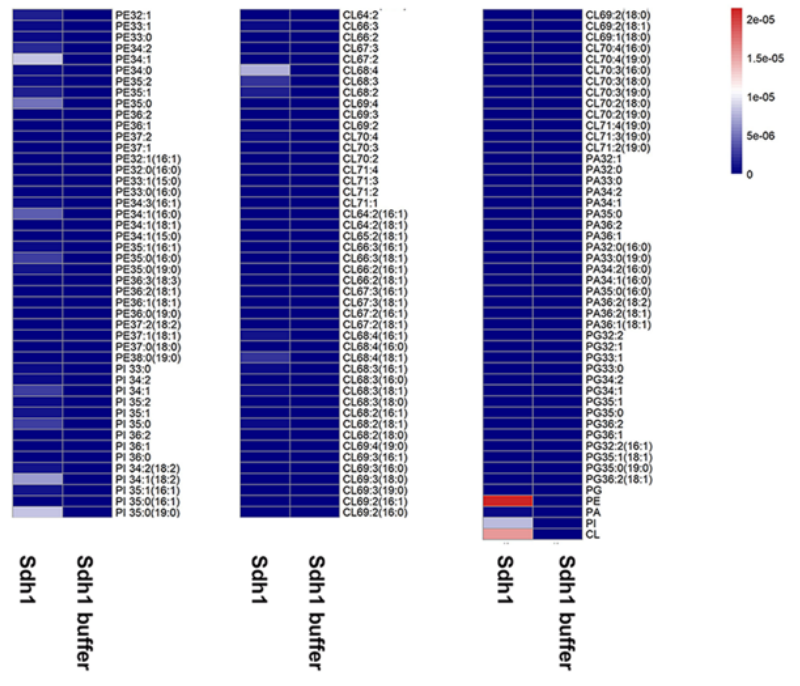
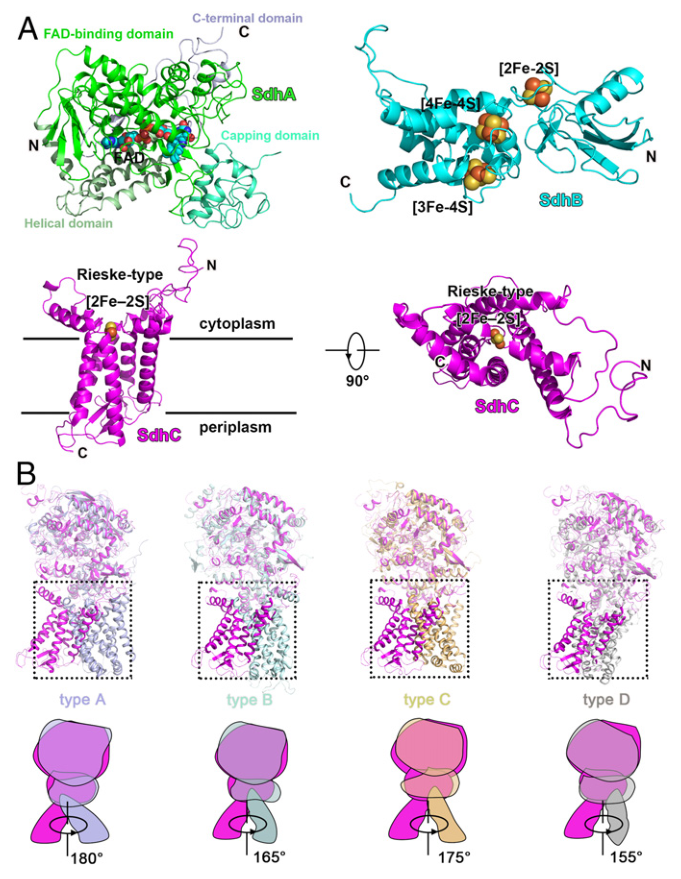
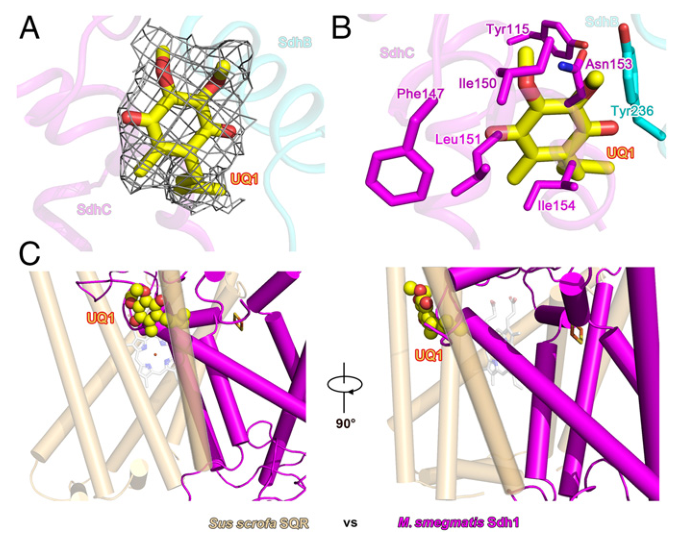
结核病(Tuberculosis)是一种由结核分枝杆菌引起的传染性疾病,目前仍是导致世界十大死因的疾病之一。根据 2020 年世界卫生组织(WHO)的统计,在全球范围内,约四分之一的人口潜伏感染结核病。由于耐多药和广耐药菌株的不断出现,造成了全球公共卫生危机,因此,新的抗结核药物的开发迫在眉睫。 Msm Sdh1的整体结构 质谱法鉴定纯化蛋白样品和缓冲液中的脂类 接着,研究人员对Sdh1的各个亚基展开解析。Sdh1由三个亚基组成,两个是水溶性的SdhA和SdhB,另一个是跨膜的SdhC。SdhA亚基可观察为四个亚结构域,分别为FAD结合结构域、封盖结构域(显著无序)、螺旋结构域和C末端结构域。相比之下,SdhB亚基的形状类似蝴蝶,仅有两个结构域。N端结构域由一个三股β-片和一个小的α-螺旋组成,C端α-螺旋结构域由六个短环区连接的α-螺旋组成。SdhC结构域类似于花,其中Rieske型[2Fe-2S]簇和跨膜螺旋分别以雌蕊和叶的形状出现。SdhC亚基的N和C末端位于跨膜区的正侧,分别对应于细胞质和周质。与其他复合物II类相比,Sdh1中可溶性结构域和跨膜结构域之间的相对取向不同。Rieske型[2Fe-2S]簇取代了膜区域中的等效b型血红素基团介导电子转移。膜锚定结构域的结构差异表明Sdh1与其他类型的复合物II相比具有不同的醌结合位点。 Msm Sdh1的组成及与A-D型复合物IIs的比较。 研究人员随后探究了Msm Sdh1中的电子传递途径,发现Rieske型[2Fe-2S]可以作为一个电子穴,首先接受来自[3Fe-4S]的电子,当[3Fe-4S]和Rieske型[2Fe-2S]都被还原时,结合的醌将被伴随的两个电子还原。在这种机制中,Rieske型[2Fe-2S]团簇将保持一个电子,直到[3Fe-4S]团簇被还原,这也可能阻止活性氧的形成,而活性氧对细胞有害。血红素b不是一个绝对的结构要求,也不是醌还原所必需的。研究人员用两个丙氨酸残基取代两个[2Fe-2S]簇His配体(His-C155和His-C240)后,发现Sdh1完全丧失醌还原活性。在Sdh1中,Rieske型[2Fe-2S]簇的出现和潜在的电子传递途径可能是分枝杆菌的一个重要适应特征。 Msm Sdh1中的修复基团和电子转移的路径。 呼吸复合物Ⅱ存在于包括细菌病原体在内的所有生命领域。然而,它们的药物开发价值在很大程度上被忽视了。不同呼吸复合物IIs中的醌结合位点具有不同的结构特征。因此,与其他醌结合位点一样,Sdh1醌结合位点也是一个潜在的药物靶点。根据涉及醌结合的跨膜亚基的序列比对,Msm和结核分枝杆菌(Mtb)具有相似的醌结合位点。类似地,哺乳动物(例如人和猪)中也存在醌结合位点。然而,Msm Sdh1和猪SQR中的醌结合位点排列不同。此外,在这两种结构三维叠加后,Msm Sdh1的醌结合位点被猪SQR中的跨膜螺旋阻断。这些结果表明,与哺乳动物相比,Msm和Mtb的醌结合位点存在显著差异,是药物开发的靶点。 与辅酶Q1结合的醌结合位点 综上所述,该研究运用单颗粒冷冻电镜技术解析了耻垢分枝杆菌Sdh1天然状态及与底物结合状态的两种高分辨率的结构,揭示了Sdh1具有新颖的电子转移途径和独特的底物结合位点。Mtb Sdh1在电子传递中的重要作用及其与哺乳动物的不同结构特征表明它是一个很好的抗细菌药物靶点,这为抗结核病的药物开发提供了结构基础。