Nature Communications:15-脂氧合酶通过IFN-β控制调节性T细胞功能促进淋巴水肿的炎症消退
2024年1月,法国图卢兹大学等单位的相关研究人员在《Nature Communications》(IF: 16.6)上发表了题为“15-Lipoxygenase promotes resolution of inflammation in lymphedema by controlling Treg cell function through IFN-β”的研究论文,揭示了15-脂氧合酶(15-LO)可通过介导调节性T(Treg)细胞减轻淋巴水肿(LD)诱导的炎症反应,为LD的治疗提供新的靶点。

-
淋巴水肿(LD)患者组织中炎症基因表达谱发生显著性变化。
-
15-脂氧合酶(15-LO)可促进特异性促炎症消退脂质介质(SPMs)和调节性T(Treg)细胞数量的增加。
-
干扰素-β(IFN−β)可恢复LD小鼠模型中15-LO的表达和Treg细胞的数量,有望成为LD炎症消退的治疗靶点。
研究背景:
淋巴水肿(LD)的特征是富含蛋白质的间质液积聚,显著的炎性细胞浸润、以及区域免疫反应失调。调节性T(Treg)细胞反应是炎症消退反应的关键环节,因为它们改善了凋亡细胞的清除率,从而提高了炎症消退。炎症消退是由衍生自多不饱和脂肪酸的特异性促炎症消退脂质介质(SPMs)协调的。
脂氧合酶(LO)催化多不饱和脂肪酸(如花生四烯酸(AA)、二十二碳六烯酸(DHA)和二十碳五烯酸(EPA))的立体选择性脱氧,其中15-脂氧合酶(15-LO)在免疫细胞和内皮细胞中组成性表达,可通过产生具有趋化活性和内皮细胞活化的SPMs来促进免疫调节。
为了广泛识别与继发性LD相关的基因表达特征,研究人员对乳腺癌后发生LD的女性进行皮肤脂肪切除术,将组织样本进行了批量RNA测序。与对照组相比,LD患者组鉴定出211个差异表达的mRNAs。层次聚类分析表明,炎症和脂质代谢相关基因在LD中被特异性调节。为了证实LD的炎症状态,研究人员对同一患者的淋巴水肿手臂和未受伤的手臂组织样本进行流式细胞术分析。在免疫细胞群(巨噬细胞、B细胞和T细胞)中,发现淋巴细胞显著积累。

图1. LD表现为炎症性特征
LD促进了肢体中脂肪组织的大量积累,在一定程度上,这是导致炎症细胞积聚的间质液滞留的原因。为了了解脂质组成是否与免疫细胞招募的变化有关,研究人员对LD患者和小鼠模型的皮肤和脂肪组织进行了脂质组学分析。对患者的检测结果发现15-LO活性降低且两种组织中SPMs的总体水平均下降。其中,由AA衍生的SPMs在淋巴水肿中显著性减少,特别是通过15-脂氧合酶(15-LO)途径合成的SPMs,如15-羟基二十碳四烯酸(15-HETE)、Lipoxin A4和B4(LXA4和LXB4),相反,由DHA代谢产生的SPMs没有任何差异。另一方面,使用LD小鼠模型探究LD炎症过程的分子机制,其结果与在人体组织样本中观察到的现象非常相似。
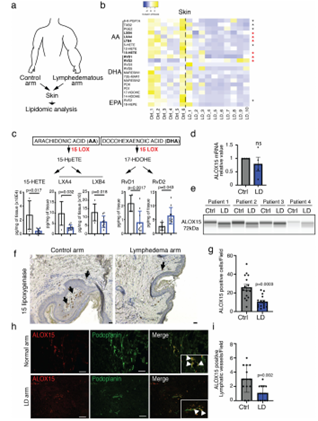
图2. LD中脂质介质的下调
接着,研究人员使用15-LO 的药理抑制剂PD146176评估其对LD的作用。在15-LO抑制剂存在下,LD肿胀增加、Treg细胞数量减少,这表明15-LO可促进组织中Treg细胞的存活,有利于LD的炎症消退。在淋巴内皮细胞中ALOX15基因(根据LOXs催化氧化AA时氧分子插入的位置以及它们各自的氧化特性命名的基因)选择性缺失 (ALOX15lecKO) 的小鼠模型中证实了即使在没有炎症过程的情况下,脂肪组织中的Treg细胞数量也明显减少,这一现象的发生是由细胞死亡的增加而非细胞增殖的减少所引起的。

图3. 淋巴内皮细胞ALOX15控制T细胞在LD中的功能
研究人员随后通过皮下注射15- LO慢病毒载体来探究15-LO治疗LD的效果,发现15-LO在小鼠淋巴内皮细胞中的表达恢复完全消除了LD的发展。有趣的是,表达15-LO的慢病毒载体并没有增加Treg细胞的总数,而是显著提高了Foxp3+PPARγ+细胞的速率,这些结果证实了15-LO和Treg细胞亚群在LD中的关键作用。此外,15-LO基因的敲除显著降低了淋巴毒素受体(LTBR)的表达,而LTBR在淋巴跨内皮Treg细胞迁移中起着至关重要的作用,这就说明淋巴内皮细胞上的15-LO能够控制Treg细胞的运输。
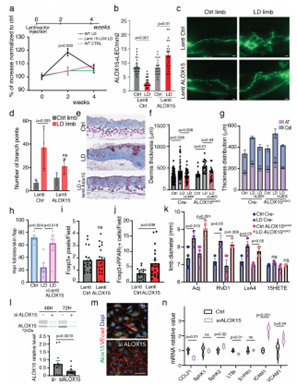
图4. 15-LO治疗可恢复LD患者的淋巴功能
近期有研究表明,由巨噬细胞产生的干扰素-β(IFN-β)可诱导真皮细胞中IL-10和12/15-LO的表达。于是实验人员通过ALOX15lecKO小鼠研究IFN是否在LD中发挥作用。结果显示,敲除ALOX15对IFN-α没有影响,但降低了IFN-β的表达。注射重组IFN-β之后,在ALOX15lecKO小鼠和对照组小鼠中观察到ALOX12/15基因表达的挽救作用,LD组织中的Treg的数量也显著性增加。
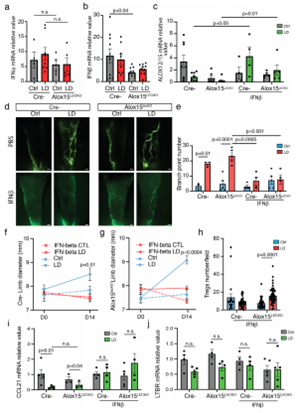
图5. INF-β可预防LD
综上所述,由15-LO途径合成的SPMs是启动Treg细胞募集和LD炎症消退的关键。IFN-β通过促进15-LO的表达有望成为LD潜在的治疗靶点。






