Cell Metabolism:COVID-19的脂质组学和代谢组学研究揭示新冠发病机制中代谢失调
2019冠状病毒病(COVID-19)的大流行对全球公共卫生构成了前所未有的威胁。这是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的,该病毒以血管紧张素转换酶2(ACE2)为宿主进入受体。众所周知,病毒会引起宿主细胞脂质体的深刻变化,并利用宿主代谢资源为病毒感染的不同阶段提供能量。唾液酸通常存在于细胞分泌物和细胞外表面,作为附着在糖蛋白和糖脂(即神经节苷脂)上的末端基序,唾液酸的裂解介导了许多病毒的结合和传播。
肺泡II型上皮细胞作为SARS-CoV-2的主要靶点,合成对调节肺功能至关重要的表面活性物质磷脂,通过胞内途径不断分泌和循环。从支气管肺泡灌洗液中分离出的外泌体介导肺泡巨噬细胞和肺泡上皮细胞之间的细胞间通讯,形成宿主防御和对空气传播病原体免疫的前沿。因此,有必要研究循环中宿主来源的外泌体是否与COVID-19的发病有关。
2020年6月,中科院遗传与发育生物学研究所、解放军总医院第五医学中心、中科脂典的相关研究人员在《Cell Metabolism》 (影响因子IF 22.42)上发表了题为“Omics-driven systems interrogation of metabolic dysregulation in COVID-19 pathogenesis”的研究论文,阐述了富含GM3的外泌体可能参与COVID-19发病机制的病理过程,并呈现了健康人群与COVID-19患者不同的最大的血浆脂质体和代谢组库。

本研究76名受试者的队列中,包括26例健康对照者和50例COVID-19不同疾病严重程度(即轻度、中度、重度)的患者。研究人员利用靶向和非靶向串联质谱联用技术来分析血浆脂质组和代谢组。对血浆样本进行了内部优化筛选后,血浆代谢组最终含有1002种代谢物(598种脂质,404种极性代谢物),这些代谢物使用71种内标物进行定量。一个由10种血浆代谢物组成的小组可有效地将COVID-19患者与健康人群区分开(AUC = 0.975)(图1)。

图1. 用于区分COVID-19患者和健康对照的血浆代谢物面板
研究人员对与COVID-19明显相关的血浆脂质组进一步分析发现,其类似于富含单唾液酸二己糖神经节苷脂(GM3)的外泌体,鞘磷脂(SMs)和GM3含量增加,二酰甘油(DAGs)含量减少(图2)。
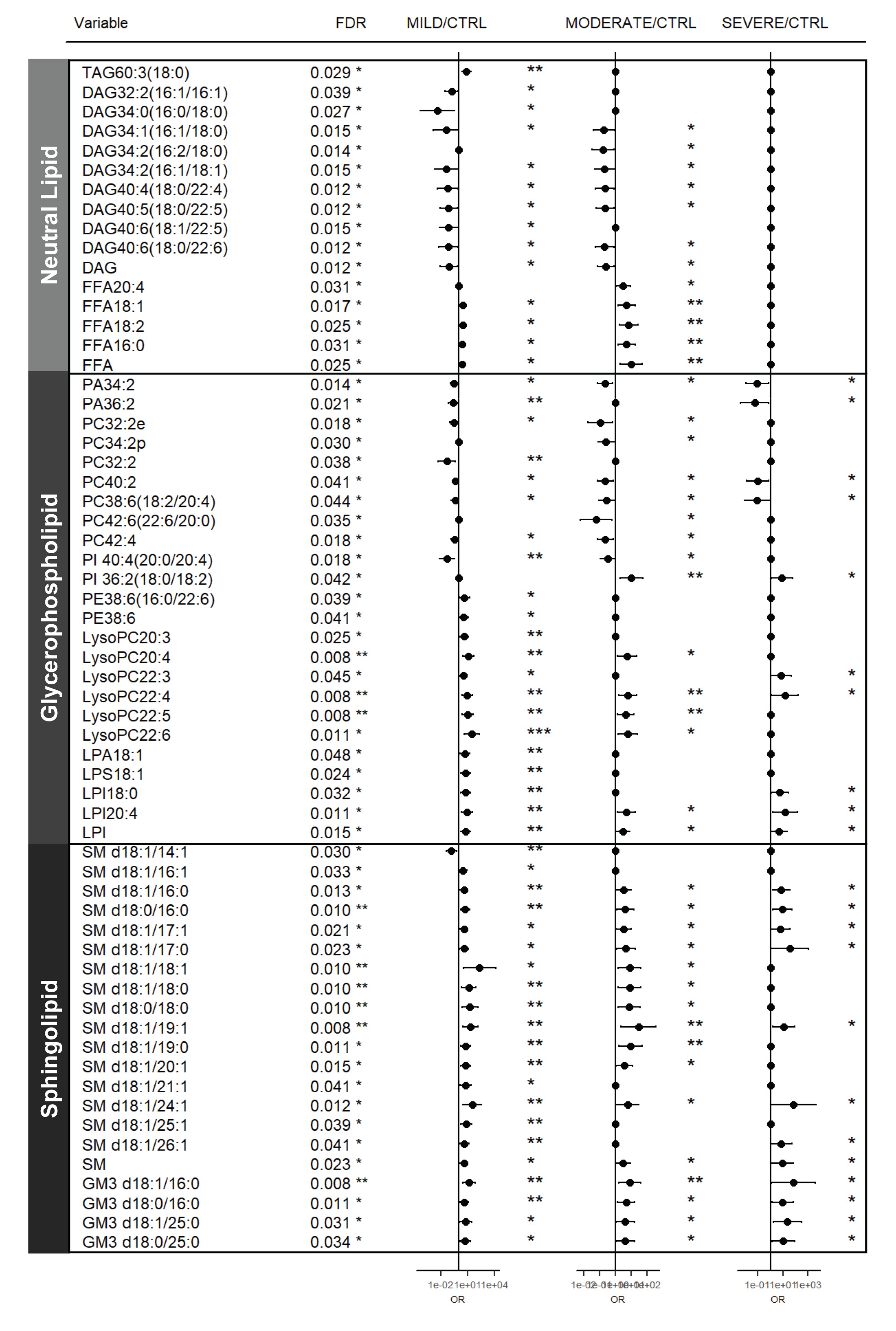
图2. 与COVID-19严重程度相关的血浆脂质
随后,研究人员评估了COVID-19的血脂变化与相关临床指标的关联性。进行Spearman相关分析(p<0.05)发现,磷脂酰胆碱(PCs),特别是多不饱和磷脂酰胆碱(PUFA-PCs)和缩醛磷脂酰胆碱(PCps),与全身炎症的临床指标(白细胞介素6(IL-6)、C-反应蛋白(CRP)、降钙素原(PCT)、红细胞沉降率(ESR)、血清铁蛋白(SF))呈显著负相关,这表明血浆PUFA-PCs和PCps的减少与全身炎症加重有关。与PCs相比,只有磷脂酰乙醇胺(PEps)而不是多不饱和磷脂酰乙醇胺(PUFA-PEs)与全身炎症的临床指标显著负相关。此外,血浆GM3是唯一一种与T细胞计数(TCellC)和CD4+T细胞计数(CD4.TCellC)呈强负相关的病理改变的脂质(图3)。

图3. 血浆脂质与临床指标的相关性
脂质水平之间的强相关性可能意味着这些脂质存在于一个共同的代谢途径上并且是共同调节的,与健康状态相比,改变疾病中脂质对之间的相关性模式可能预示着病理上相关的代谢失调。因此,为了破译感染早期的脂质途径失调,研究人员使用多尺度嵌入式差分相关网络分析对COVID-19中的代谢异常进行系统评估,揭示与病理相关的脂质模块(图4)。

最后,研究人员对从同一队列的血浆中分离的外泌体进行脂质分析,验证了基于血浆脂质组的假设,发现疾病严重程度升高的COVID-19患者的外泌体中越来越多地富含GM3(图5)。
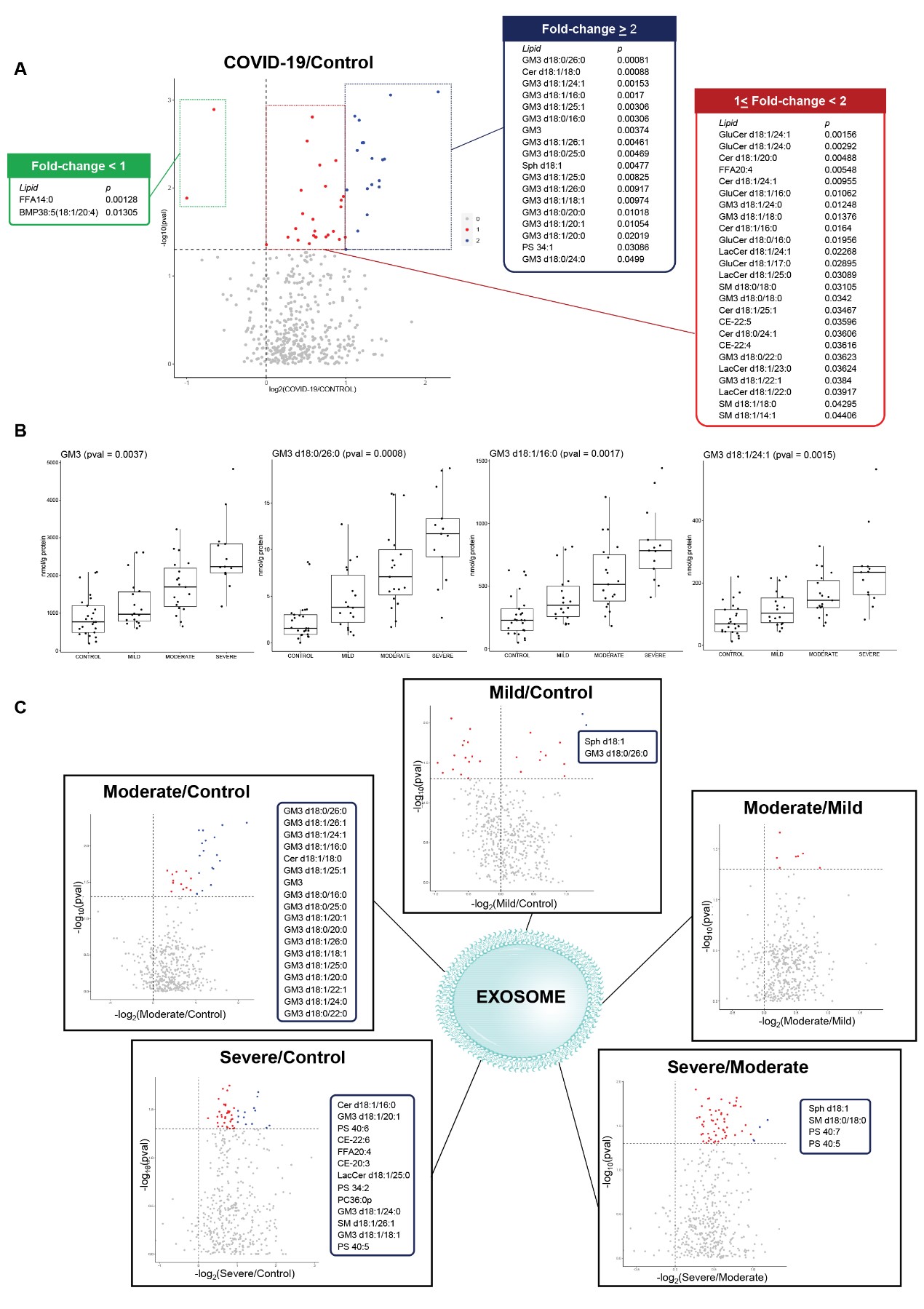
图5. COVID-19患者外泌体的脂质变化






