Science Bulletin: 黄勋团队揭示Cds2调节线粒体磷脂含量和线粒体功能影响NASH的快速发生
2021年10月,中科院遗传与发育生物学研究所等单位的相关研究人员在《Science Bulletin》(IF: 11.8)上发表了题为“Hepatic CDP-diacylglycerol synthase 2 deficiency causes mitochondrial dysfunction and promotes rapid progression of NASH and fibrosis”的研究论文,揭示了小鼠肝脏 Cds2 对非酒精性脂肪性肝炎发生的影响及相关机制。

肝脏特异敲除 CDP-二酰基甘油合成酶-2(Cds2)小鼠快速产生肝脏脂肪大量储积、肝炎和肝纤维化等一系列肝脏病变。
敲除 Cds2 会导致线粒体功能受损和线粒体磷脂酰乙醇胺含量下降。
肝脏过表达线粒体磷脂酰乙醇胺合成酶(Pisd)会增加线粒体磷脂酰乙醇胺含量,并减轻了肝脏 Cds2 敲除小鼠肝损伤的表型。
过表达 Cds2 可以抵抗高脂喂食诱导的脂肪肝和肥胖。
线粒体功能对肝功能至关重要。临床证据表明,线粒体脂质成分可能会影响肝功能。在西方饮食诱导的小鼠NAFLD过程中,线粒体磷脂酰胆碱 (PC)、PE 和 PS 水平降低。线粒体PC-PE比率与肝细胞中的细胞ATP水平呈负相关。然而,线粒体磷脂成分的改变是否是NAFLD的病因尚不清楚,线粒体磷脂在纤维化等晚期肝病发病机制中的作用尚不清楚。

研究人员首先测试了CDS2在NAFLD中的参与,发现CDS2在遗传和饮食诱导的NAFLD小鼠模型中被下调。为了探究其在NAFLD发病机制中的作用,研究人员构建了肝脏特异敲除Cds2小鼠(Cds2f/f;AlbCre小鼠)。H&E和油红O染色显示,Cds2f/f;AlbCre小鼠在5周龄时表现出肝重比增加和肝脏脂肪变性增加。此外,通过脂质组学分析和13C棕榈酸示踪分析显示,Cds2的缺乏导致脂肪酸流向中性脂质TAG的通量增加。
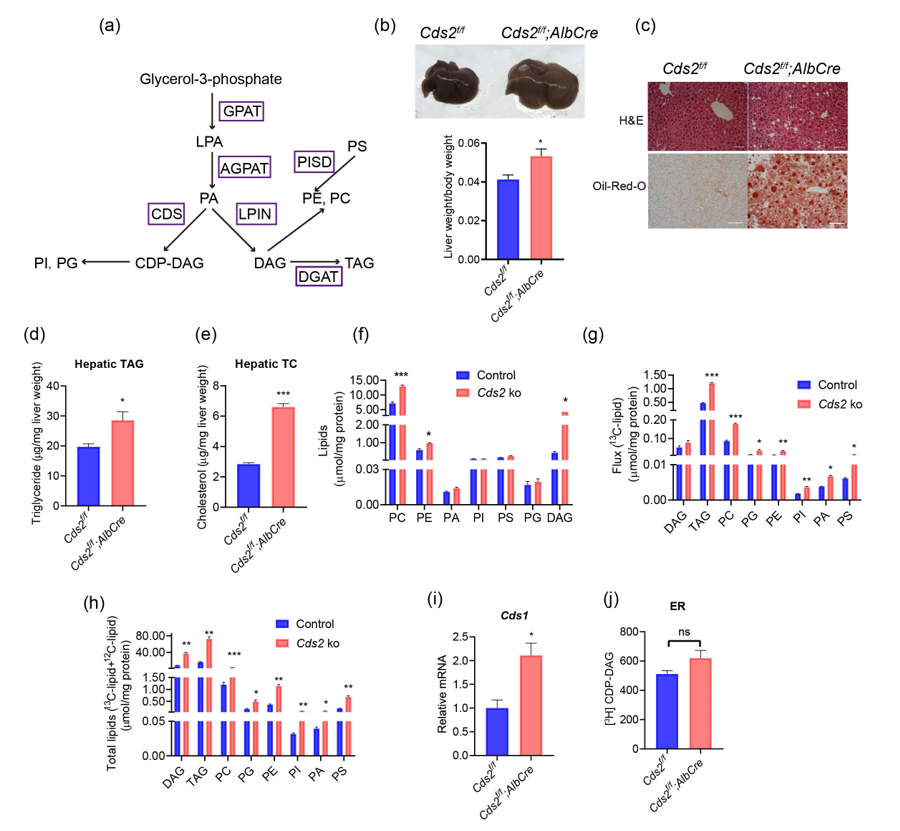
肝脏Cds2缺乏导致肝脏脂肪变性
进一步分析Cds2f/f;AlbCre小鼠的肝脏显示,5周龄Cds2f/f;AlbCre小鼠肝脏切片中伴有脂肪变性的小叶炎症。血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平升高。与对照组小鼠相比,Cds2f/f;AlbCre小鼠肝脏促炎基因的表达增加,纤维化明显增强,其肝脏切片细胞死亡(对照组小鼠没有)。此外,1岁雄性Cds2f/f;AlbCre小鼠出现肝脏肿瘤,对照组小鼠未观察到。这些数据表明,肝脏Cds2缺乏会导致肝脏炎症、纤维化、细胞死亡和肝脏肿瘤。

肝脏Cds2缺乏导致肝脏炎症和纤维化
接下来,研究人员进行了RNAseq分析,以进一步了解肝Cds2缺乏导致肝损伤的机制。Cds2f/f;AlbCre和对照组小鼠之间改变最显著的途径与线粒体内膜、氧化磷酸化、TCA循环和呼吸电子传递有关。这表明肝线粒体在体内受到Cds2缺乏的影响。线粒体DNA评估显示,与对照组小鼠相比,Cds2f/f;AlbCre小鼠的肝脏线粒体DNA含量降低了约40%。此外,Cds2f/f;AlbCre小鼠呼吸链复合体中的蛋白质水平、线粒体复合物I和II的活性也降低了。
线粒体是高度动态的细胞器,不断发生裂变和融合。对线粒体相关动力蛋白表达的分析显示,Cds2缺陷时线粒体融合缺陷,而裂变没有受到影响。与线粒体融合减少一致的是,电子显微镜(EM)分析显示,与对照组小鼠相比,Cds2f/f;AlbCre小鼠肝脏切片的线粒体面积减少。Cds2f/f;AlbCre小鼠线粒体呼吸受损,脂肪酸氧化(FAO)的基因显著下调,表明FAO受损。使用[3H]标记的棕榈酸酯直接测量FAO表明,Cds2f/f;AlbCre小鼠肝脏中的棕榈酸酯氧化显著降低。这些结果提供了肝Cds2在体内调节线粒体含量、功能和动力学的证据。
线粒体功能受损和FAO基因下调使得研究人员进一步探索改善线粒体功能是否可以缓解Cds2f/f;AlbCre小鼠的NASH样表型。非诺贝特(fenofibrate)是一种PPARα激动剂,已知可增加线粒体生物发生并增强FAO。非诺贝特D 治疗结果表明,PPARα活化减轻了肝脏Cds2缺乏诱导的NASH样表型。
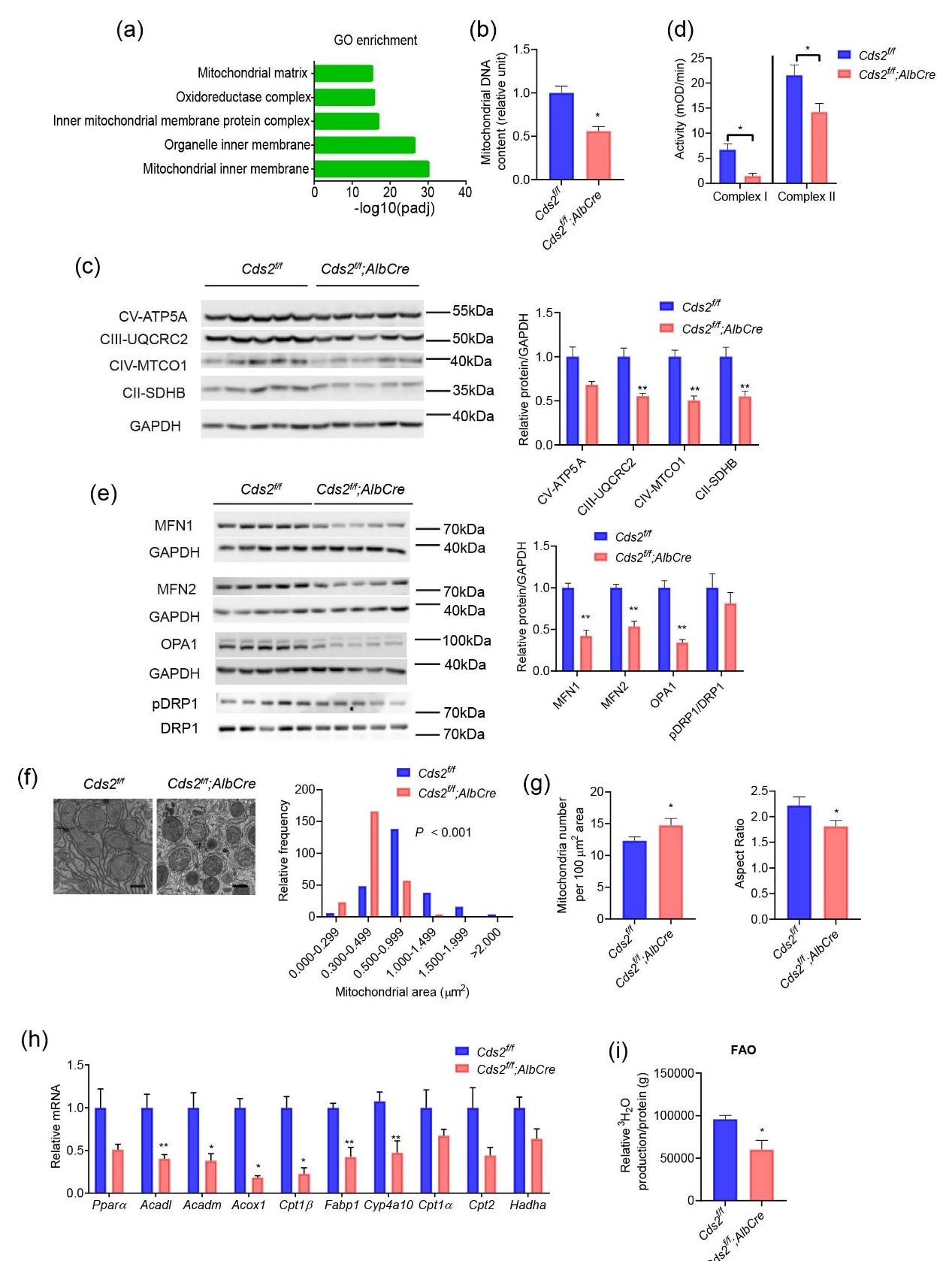
Cds2影响线粒体含量和呼吸复合物的活性和动力学
随后,研究人员探究了Cds2缺失如何影响线粒体形态和功能。研究人员使用顺序离心分离技术检测了CDS2蛋白的亚细胞定位。与之前的研究结果一致,在ER中检测到CDS2蛋白,但在纯线粒体中检测不到。有趣的是,CDS2存在于MAMs部分,该部分由紧密相连的ER和线粒体膜组成,这些膜具有多种脂质生物合成酶活性。MAMs对于PS从ER转移到线粒体至关重要,PS通过线粒体PISD转化为PE。Cds2f/f;AlbCre小鼠线粒体中总PE和最丰富的PE,PE38:4的水平显着降低。EM分析显示,Cds2f/f;AlbCre小鼠肝细胞内质网与线粒体之间的距离增加。这些结果表明CDS2在MAMs中富集,并调节线粒体磷脂组成。
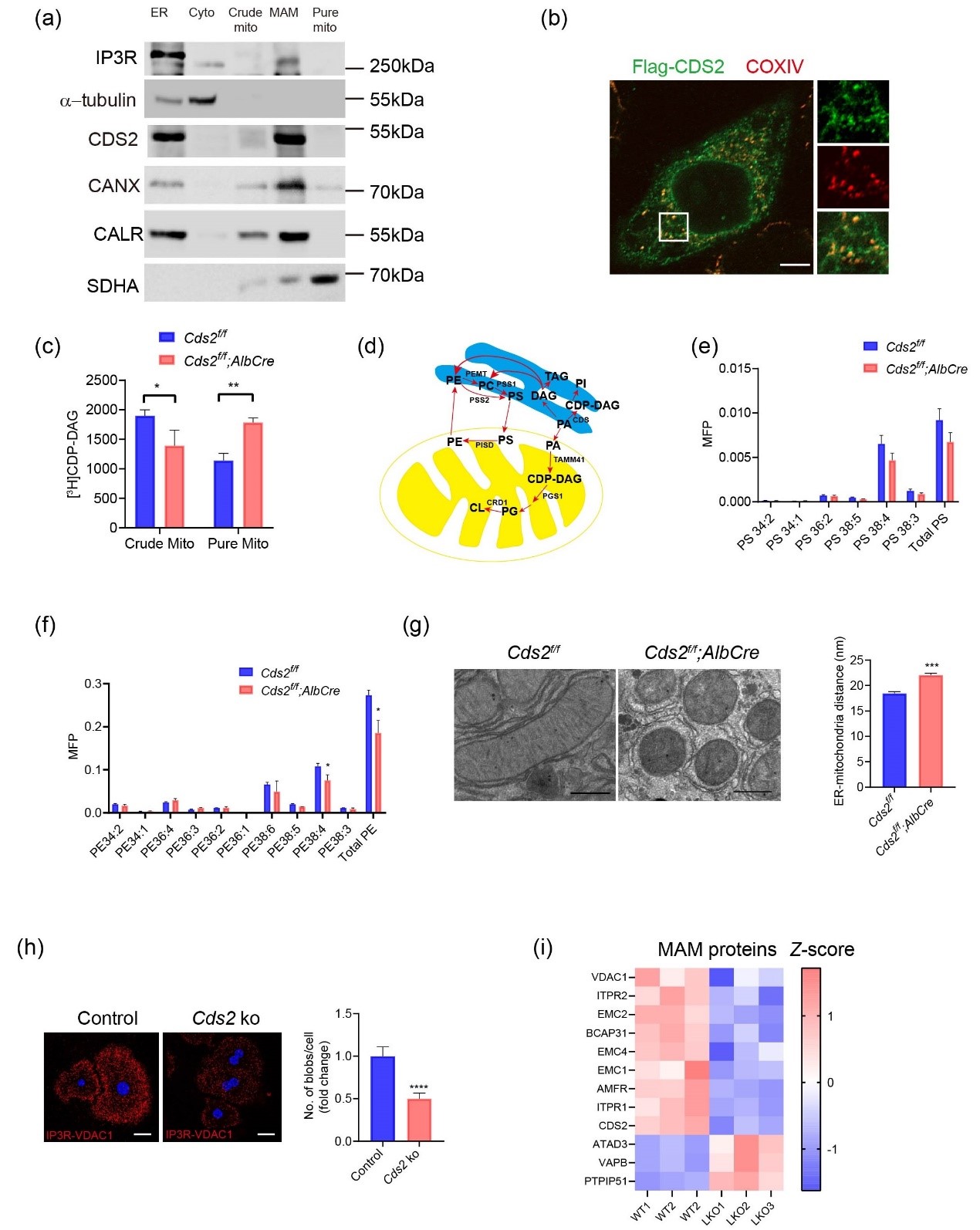
CDS2在MAMs中富集,CDS2缺乏影响MAM蛋白和线粒体磷脂组成
由于线粒体PE对线粒体功能至关重要,在Cds2f/f;AlbCre小鼠中线粒体PE水平降低,研究人员接着探究通过过表达Pisd提高线粒体PE水平是否可以改善Cds2缺陷引起的线粒体缺陷。结果表明,Pisd过表达降低了肝脏甘油三酯、血浆ALT和AST水平,并降低了促炎基因和纤维化基因的表达。与对照组相比,Pisd过表达Cds2f/f;AlbCre小鼠的肝脏脂肪变性和纤维化减少,肝脏中的FAO增强,挽救了CDS2敲减(CDS2 kd)肝细胞的线粒体片段化和耗氧率(OCR)的降低,说明过表达Pisd可改善CDS2缺失引起的肝细胞线粒体缺陷。这些结果提示Pisd在肝脏过表达可改善Cds2f/f;AlbCre小鼠线粒体功能,缓解NASH样表型。
最后,研究人员探究了Cds2过度表达是否能够预防HFD诱导的脂肪肝和肥胖。发现Cds2的过度表达能减弱体重的增加,降低血浆总胆固醇和肝脏TAG的水平,改善HFD诱导的肝脏脂肪变性和肝脏炎症并降低了ALT和AST水平。此外,Cds2的过度表达增加了线粒体的数量以及线粒体中的PC和PE水平。这些数据表明肝脏Cds2过度表达可预防HFD诱导的肥胖和脂肪肝。
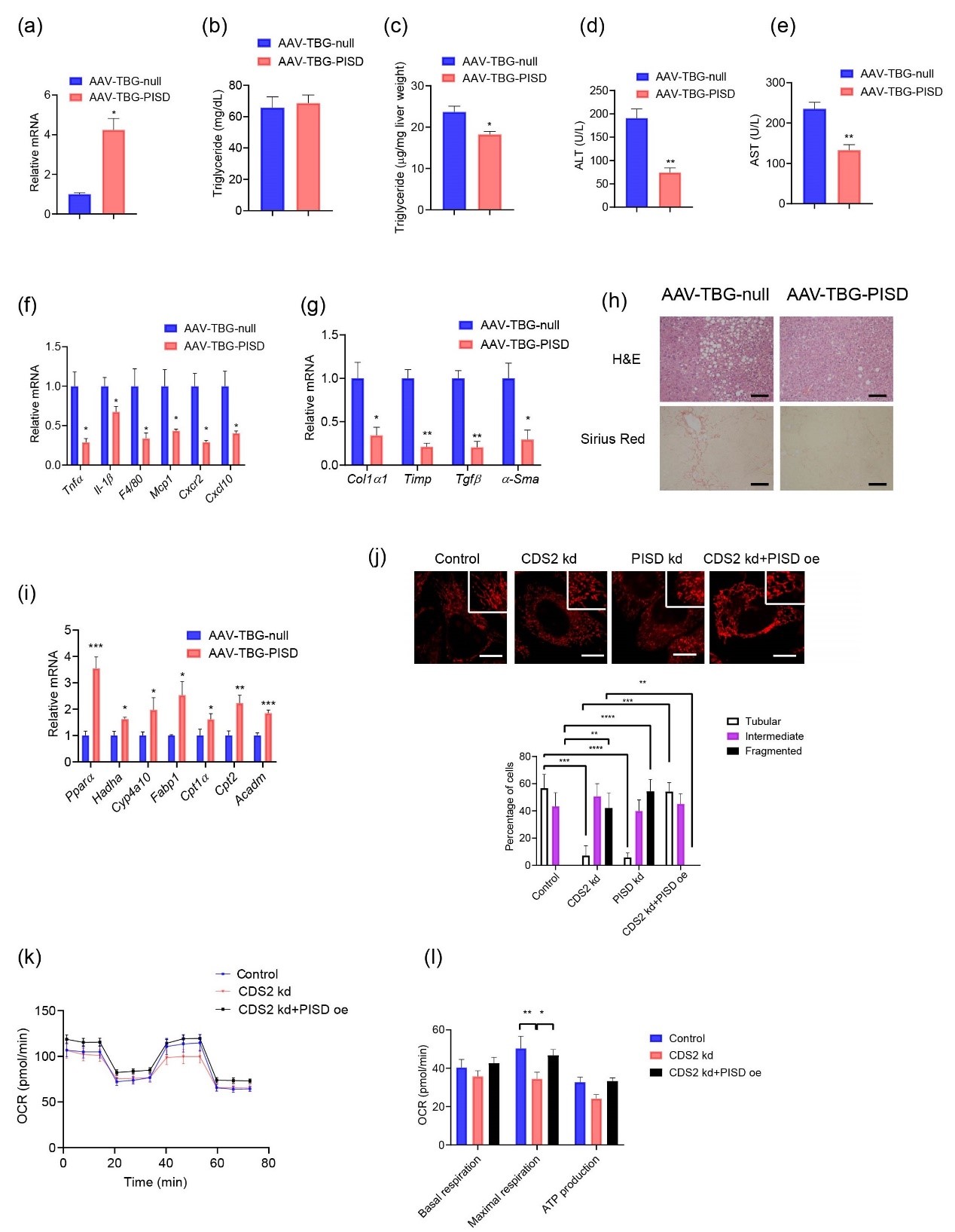
Pisd的过表达减轻了Cds2f/f;AlbCre小鼠的NASH样表型
综上所述,该研究表明,CDS2在遗传和饮食诱导的NAFLD小鼠模型中下调。肝脏Cds2缺乏导致肝脏脂肪变性、炎症和纤维化。从机制上讲,Cds2 缺乏会损害线粒体的形态、脂质组成和功能。通过过度表达Pisd增加线粒体PE合成可减轻Cds2f/f;AlbCre小鼠的NASH 样表型。Cds2 的过表达可防止 HFD 诱导的肥胖和脂肪肝。本研究为 Cds2 在维持线粒体形态、脂质组成和功能中的作用提供了证据,并提供了一个不需要二次饮食或化学肝毒性损伤的体内模型,以获得从脂肪变性到 NASH和纤维化转变的机制见解。
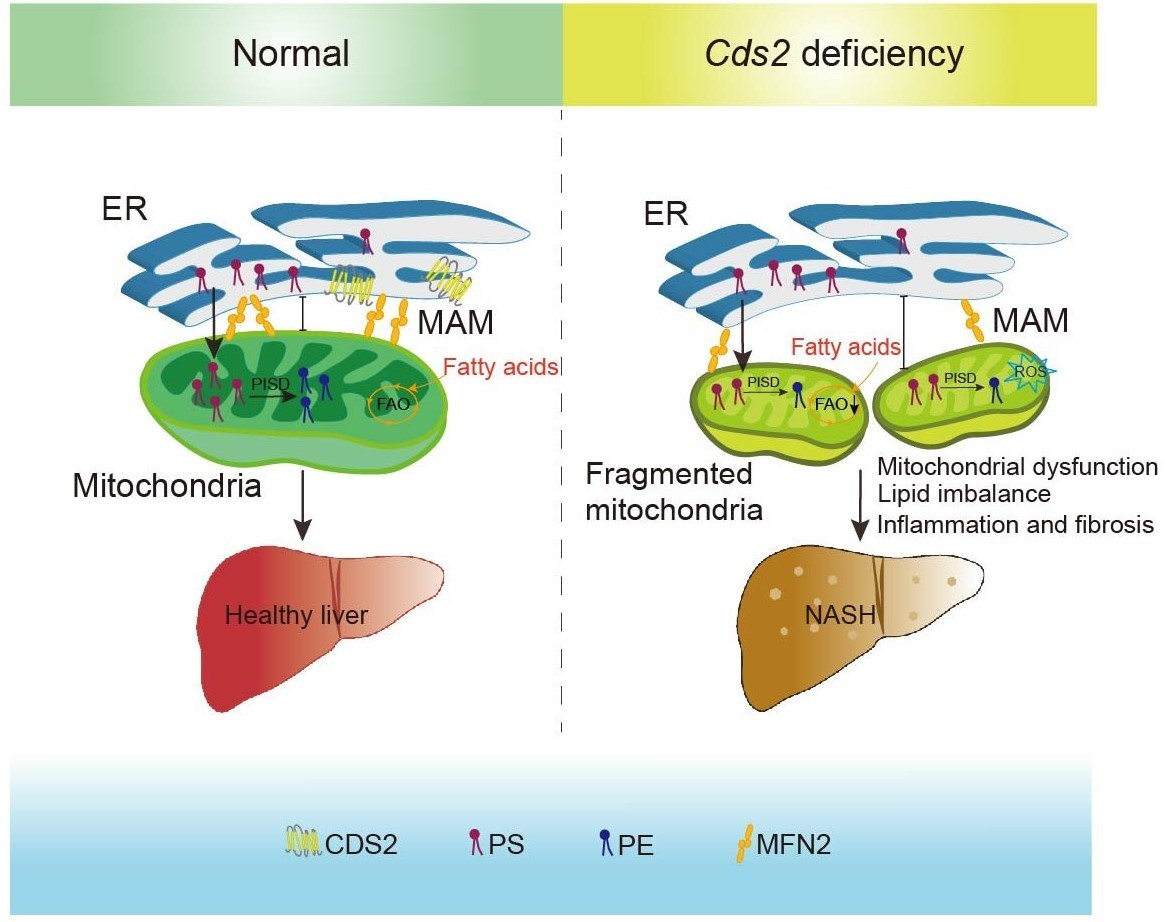
Cds2缺乏如何促进NASH发展的模型





